تعبيراتُ ثابت الاتّزان والحساباتُ المُتعلّقة به
(ثابت الاتّزان)
درسنا سابقًا
العواملُ المؤثّرة في الاتّزان
وأنه عند وصول التفاعُل إلى حالة الاتّزان يستمر حدوث التفاعُل بالاتجاهين الأماميّ والعكسي بالسرعة نفسها وتبقى تراكيز الموادّ الناتجة والمُتفاعلة ثابتةً.
ويمكنُ التأثير عليها بإزاحة موضِع الاتّزان نحو اليسار أو اليمين بتغيير ظروف التفاعل؛ وهي: التركيز، الضغط، درجة الحرارة
ويصلُ التفاعُل إلى حالة الاتّزان من جديد
♯ تعبيرُ ثابت الاتّزان:
توصّلَ العالمان النرويجيان كاتو جولدبيرج Cato Guldbergوبيتر وييج Peter Waage عن طريقِ دراستهما للتّفاعُلات المُتّزنة إلى علاقة تصفُ حالة الاتّزان سميت:
"قانون فعل الكتلة"
وينصُّ على:
«عند درجة حرارة معينّة يصل التفاعُل إلى حالة تكون عندها نسبة تراكيز المواد المُتفاعلة إلى تراكيز المواد الناتجة مرفوعًا كُلًّ منها إلى قوّة تساوي معاملاتها، قيمة ثابتة»
وهذه القيمة الثابتة تسمى: ثابت الاتّزان
ويُرمَز له Keq
يُمثّل حاصل ضرب تراكيز المواد الناتجة مقسومًا على حاصل ضرب تراكيز المواد المُتفاعلة مرفوعًا كُلًّ منها إلى قوّة تساوي معاملاتها (a , b , c , d)
* يُعبّر عن ثابت الاتّزان (Keq)بدلالة التراكيز المولارية للمواد المُتفاعلة والناتجة
ولذلك يُرمز لثابت الاتّزان في هذه الحالة (Kc)
مثال: تُصنعُ الأمونيا NH3 بطريقة هابر وفقَ المعادلة الآتية
* ماذا يستفادُ من قيمةِ ثابت الاتّزان؟
1) تحديدِ الجهة التي يُزاح إليها الاتّزان
2) حسابِ كميّات المواد الناتجة والمُتفاعلة عند الاتّزان
◄ فإذا كانت قيمةُ ثابت الاتّزان أكبر من واحد Kc > 1
يكونُ موضع الاتّزان مُزاحًا إلى جهة المواد الناتجة وتكون تراكيزُ الموادّ الناتجة أكبر من تراكيز المواد المُتفاعلة، وبهذا يكون مردودُ التفاعُل أكبر
◄وإذا كانت قيمةُ ثابت الاتّزان أقل من واحد Kc < 1
يكونُ موضع الاتّزان مُزاحًا إلى جهة المواد المُتفاعلة، وتكون تراكيز المواد الناتجة أقلّ من تراكيز المواد المُتفاعلة ويكون مردود التفاعُل قليلًا.
* كما يمكن التعبيرُ عن ثابت الاتّزان للتفاعُل بدلالة الضغوط الجزئية للغازات في وعاء التفاعُل بدلًا من تراكيزها:
ولذلك يُرمز لثابت الاتّزان في هذه الحالة (KP)
مثال: تُصنعُ الأمونيا NH3 بطريقة هابر وفقَ المعادلة الآتية:
ألاحظُ أن المواد في تفاعُل الأمونيا تكون جميعُها في الحالة الغازية
# كثيرٌ من التفاعُلات الكيميائيّة تكون فيها المواد في حالاتٍ فيزيائيّة مختلفة
ولذلك يمكنُ تصنيف الاتّزان تبعًا إلى الحالة الفيزيائية للمواد إلى نوعين هما:
1) اتّزان متجانس 2) اتزان غير متجانس
1) اتّزان متجانس
حالة الاتّزان التي تكون فيها الموادّ المُتفاعلة والناتجة جميعها في الحالة الفيزيائية نفسِها سواء أكانت غازات أم محاليل.
ويُعبّر عن ثابت الاتّزان لهذه التفاعُلات بدلالة تراكيز المواد كلّها في التفاعُلِ
مثال: يتفاعل غاز الأمونيا مع غاز الأكسجين وينتج غاز ثاني أكسيد النيتروجين وبخار الماء كما في المعادلة:
2) اتزان غير متجانس
حالة الاتّزان التي تكون فيها الموادّ المُتفاعلة والناتجة في حالة فيزيائية متنوعة (صلبة، أو سائلة، أو غازية).
وقد وجد أن تراكيز المواد الصلبة النقية في التفاعُلِ تبقى ثابتةً؛ إذْ إنَّ كمية المادة في وحدة الحجم منها تبقى ثابتة، فهي لا تُؤثّر في ثابت الاتّزان ولا تكتب في تعبير ثابت الاتّزان.
مثال: تتحلُّل كربونات الكالسيوم الصلبة CaCO3 بالحرارة في وعاء مُغلق كما في المعادلة الآتية:
مثال: يتحلُّل الماء السائل وفقَ المعادلة الآتية:
وكذلك عندما يكون الماء مذيبًا، أي في المحاليل المائية مثل إذابة الحموض أو القواعد الضعيفة في الماء فلا يتم التعبير عنه في ثابت الاتزان.
(الحساباتُ المُتعلّقة بثابت الاتّزان)
تبين الجداول الثلاث الآتية، قيمُ ثابت الاتّزان لتفاعُل الأمونيا في تجارب عدّةٍ عند درجة حرارة C˚500
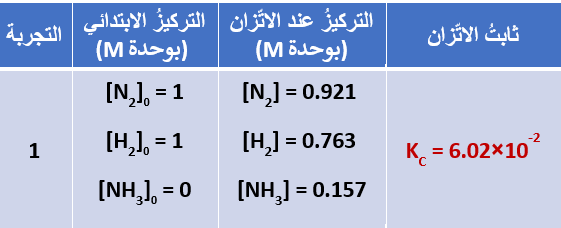
نلاحظ أن قيمة ثابت الاتزان تعتمد عمليًّا على تراكيز المواد في وعاء التفاعُل عند الاتّزان
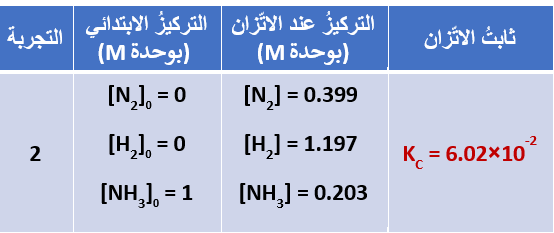
نلاحظ عدم تغير قيمة ثابت الاتّزان؛ رغم تغير قيمة التركيز لكل من المواد المتفاعلة والناتجة.
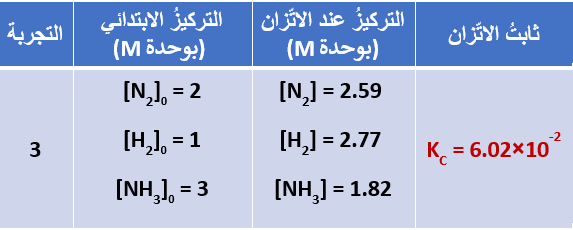
كما نلاحظ أن قيمة ثابت الاتزان لم تتأثر بالتراكيز الابتدائية للمواد في التفاعُلِ
مثال: يُصنَع غاز الميثان وفقَ المعادلة الآتية:
أحسبُ ثابت الاتّزان إذا احتوى وعاءٌ حجمُه 2L على 0.6 mol من CO، و 0.2 mol من H2 ، و 0.12 mol من CH4 ، و0.04 mol من H2O عند الاتّزان.
الحل:
أولًا: نحسب التركيز المولاري لكلّ غاز في وعاء التفاعُل، وفق العلاقة الرياضية الآتية:
ثانيًا: نحسب قيمة ثابت الاتّزان:
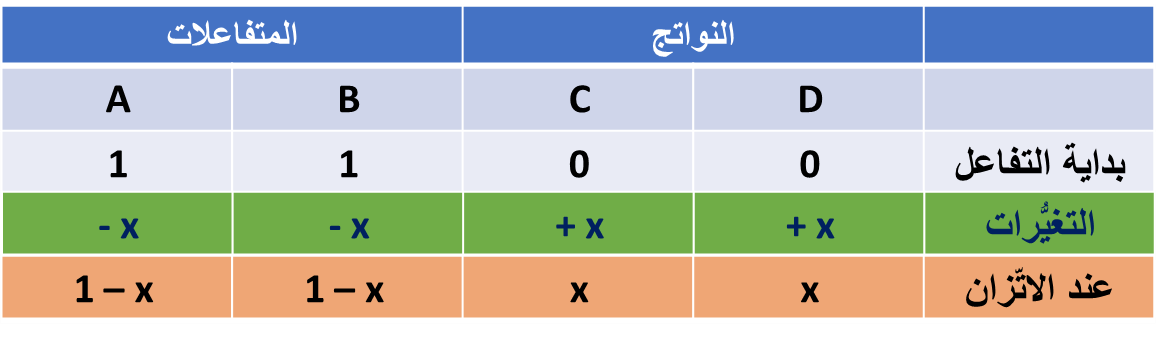
(دراسة التغيُّرات التي تطرأ على التراكيز منذ بداية التفاعل وصولًا إلى الاتّزان)
A + B ⇌ C + D
مثال: يتحلّلُ غازُ يوديدِ الهيدروجين HI ، وينتَجُ خليطٌ من غازِ الهيدروجين H2 وبخارِ اليودِI2 كما في المعادلة الآتية:
فاذا أُدخلَ4mol من يوديدِ الهيدروجينHI إلى وعاءٍ حجمُه 5L عند درجة حرارة ˚485 C؛ نجد أنَّ الوعاءَ عندَ الاتّزانِ يحتوي0.442mol من بخارِ اليود I2
أحسبُ ثابتَ الاتّزانِ للتفاعُل عندَ درجةِ الحرارة هذه.
الحل:
أولًا: نحسب التركيز المولاري وفق العلاقة الآتية، لكل من HI و I2 :
ثانيًا: نحسب تراكيزَ جميعِ الموادّ عندَ الاتّزانِ كما يأتي:

x = [H2] = [I2] = 0.0884 M
[HI]= 0.8 – [2×(0.0884)] = 0.623 M
ثالثًا: نحسب ثابت الاتّزان للتفاعل:
«حسابُ تراكيز المواد عند الاتّزان»
يمكنُ حساب تراكيز المواد في التفاعُلِ عند الاتّزان باستخدام ثابت الاتّزان
مثال: يتفاعُل غاز أول أكسيد الكربون COمع بخار الماء لإنتاج ثاني أكسيد الكربون CO2 والهيدروجين H2كما في المعادلة الآتية:
فإذا أُدخِل 1mol من جميع هذه الغازات إلى وعاءٍ حجمه1L ، وكان ثابت الاتّزان عند 700K يساوي5.10 ، أحسبُ تراكيز كلّ من هذه الغازات عند الاتّزان.
أولًا: نحسب التركيز المولاري الابتدائي لكلّ غاز في وعاء التفاعُل، وفق العلاقة الرياضية الآتية:
◄نلاحظ أن: عدد مولاتِ الغازات جميعها متساوية ونسبها في المعادلة الموزونة متساوية
ثانيًا: ننظم التغيُّرات التي تطرأ على تراكيز الموادّ على النحو الآتي:

ثالثًا: نطبق في ثابت الاتّزان كما يأتي:
وبأخذ جذر الطرفين أحصل على ما يلي:
ومنها أجد أن:
2.26(1 - x) = 1 + x
x = 0.387
رابعًا: نحصل على تراكيز الغازات عند الاتّزان بتعويض قيمة x كما يأتي:
[CO] = [H2O] = 1 – x = 1- 0.387 = 0.613 M
[CO2] = [H2] = 1 + x = 1 + 0.387 = 1.387 M
"ثابت الاتّزان لمحاليل الحموض والقواعد الضعيفة"
أولًا: ثابت الاتّزان لمحاليل الحموض الضعيفة
HA(aq) + H2O(l) ⇌ H+(aq) + A- (aq)
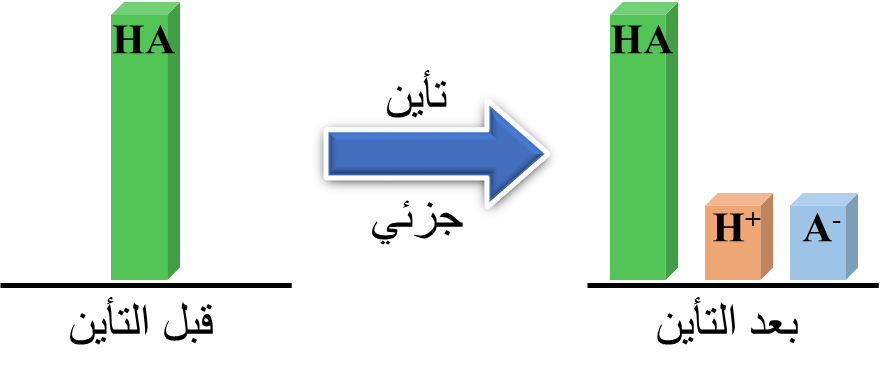
تتأيَّن الحموض الضعيفة Weak Acids جزئيًّا في الماء منتجة أيون الهيدروجينH+ وأيونًا آخر سالبًا.
* يجب الإشارة أولًا إلى أن:
أيون الهيدروجين H+ بروتون صغير الحجم وكثافة الشحنة الموجبة عليه عالية جدًا؛ ولذلك يصعب تواجده بصورة حرة (منفردًا) في المحاليل المائية
HA(aq) + H2O(l) ⇌ H3O+(aq) + A- (aq)
يتكون أيون موجب يسمى: أيون الهيدرونيوم
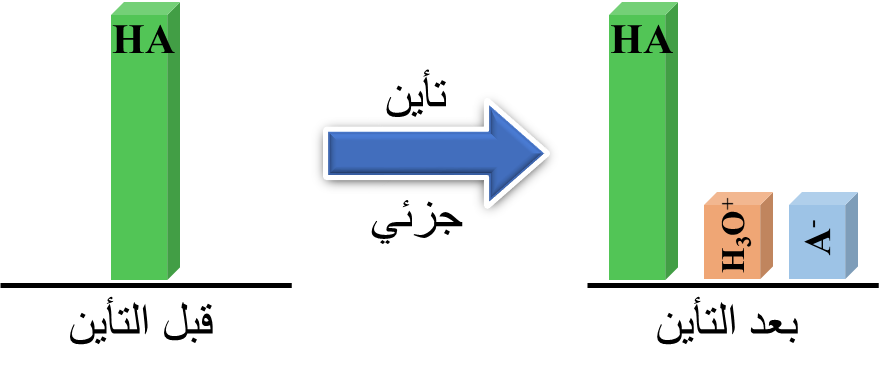
يحتوي محلول الحمض الضعيف تراكيز متّزنة من جزيئات الحمض غير المُتأيِّنة HA والأيونات الناتجة عنه (-H3O+ , A)
♯ يكون موضِع الاتّزان للحموض الضعيفة جميعها مُزاحًا جهة اليسار
✓ ما يعني أنّ تراكيز الأيونات الناتجة صغيرة جدًّا مُقارنة بتركيز الحمض غير المُتأيِّن.
HA(aq) + H2O(l) ⇌ H3O+(aq) + A- (aq)
♯ولأن تركيز الماء ثابت يدمج مع ثابت الاتّزان ينتج ثابتًا جديدًا
يسمى ثابت تأين الحمض الضعيف
وقد وجد عمليًّا أن:
مثال: أعبّرُ عن ثابت التأيُّن لكلّ من:
1) HNO2(aq) + H2O(l) ⇌ H3O+(aq) + NO2-(aq)
الحل:
2) HCOOH(aq) + H2O(l) ⇌ H3O+(aq) + HCOO-(aq)
الحل:
قيم ثابت التأيُّن لعدد من الحموض عند درجة حرارة ˚25C
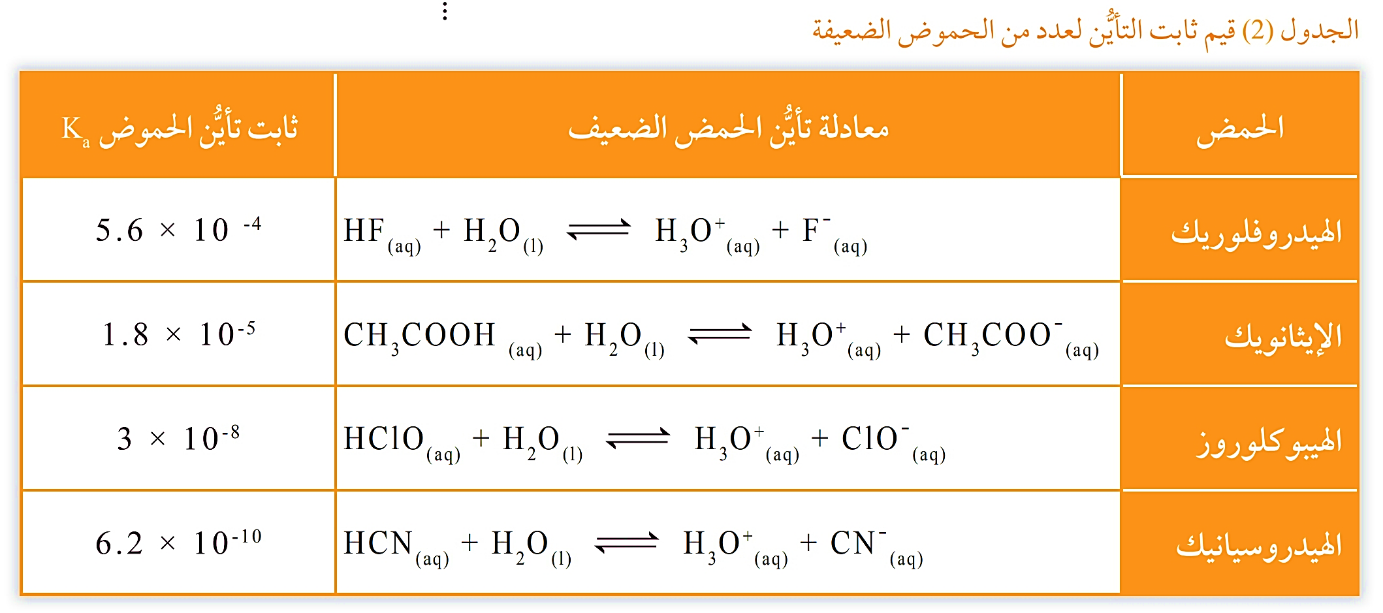
♯ تتفاوت قدرة الحموض الضعيفة على التأيُّن، ويُعدُّ ثابت تأيُّنها مقياسًا كميًّا لمدى تأيُّنها
** ماذا يستفادُ من ثابت تأيُّن الحمض؟
- مقارنة قوة الحموض وقدرتها على التأيُّن.
- حساب تركيز أيون الهيدرونيوم .H3O+
- حساب الرقم الهيدروجيني pH للمحلول.
ثانيًا: ثابت الاتّزان لمحاليل القواعد الضعيفة
⇌ BH+(aq) + OH- (aq) B(aq) + H2O(l)
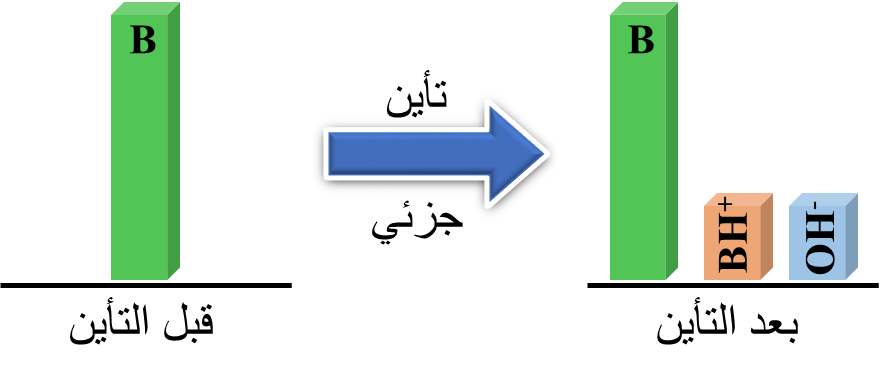
تتأيَّن القواعد الضعيفة Weak Bases جزئيًّا في الماء منتجة أيون الهيدروكسيدOH- وأيونًا آخر موجب.
يحتوي محلول القاعدة الضعيفة تراكيز متّزنة من جزيئات القاعدة غير المُتأيِّنة B والأيونات الناتجة عنها (-BH+ , OH)
♯ ويُعبّر عن ثابت الاتّزان كما في المعادلة الآتية:
♯ ومع دمج تركيز الماء مع ثابت الاتّزان ينتج ثابتًا جديدًا
يسمى ثابت تأين القاعدة الضعيفة
قيم ثابت التأيُّن لعدد من القواعد الضعيفة عند درجة حرارة ˚25C
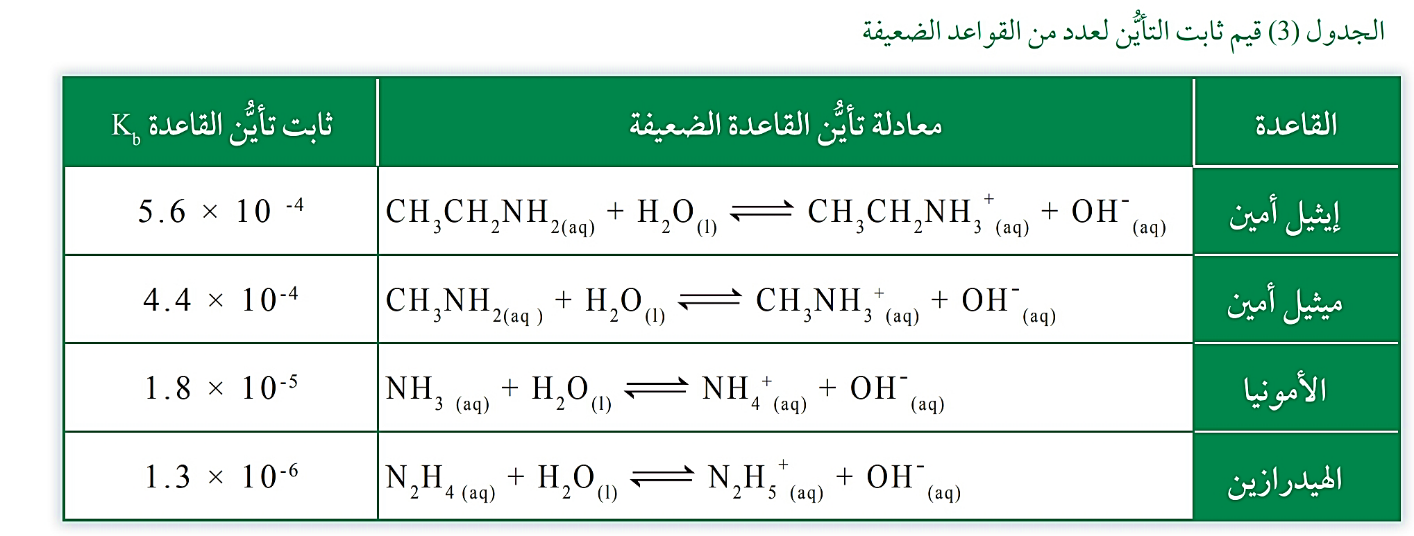
♯ تتفاوت قدرة القواعد الضعيفة على التأيُّن، ويُعدُّ ثابت تأيُّنها مقياسًا كميًّا لمدى تأيُّنها
** ماذا يستفادُ من ثابت تأيُّن القاعدة؟
- مقارنة قوة القواعد وقدرتها على التأيُّن.
- حساب تركيز أيون الهيدروكسيد OH-.
- حساب الرقم الهيدروجيني pH للمحلول.
مثال: أكتبُ معادلة تأيُّن كلّ من، ثم أعبّرُ عن ثابت التأيُّن لكلّ منهما:
NH3 ❶
الحل:
NH3(aq) + H2O(l) ⇌ NH4+(aq) + OH-(aq)
CH3NH2 ❷
الحل:
CH3NH2(aq) + H2O(l) ⇌ CH3NH3+(aq) + OH-(aq)