المفاهيم:
•المخلوط Mixture : مزيجٌ من مادّتين نقيّتين أو أكثر، تبقى كلٌّ منها محتفظةً بخصائصها الكيميائيّة.
•المحلول Solution : مزيجٌ من مادّتين أو أكثرَ لا يحدثُ بينهما تفاعلٌ كيميائيّ، وتنتشرُ جُسيماتُ المُذاب على نحوٍ منتظم ومتماثل في جميع أنحاء المُذيب.
الذائبيّةُ Solubility: بأنها أكبرُ كتلة منَ المُذاب التي يمكن أن تذوبَ في 100g منَ المُذيب (الماء) في درجة حرارة معيّنة، أو كميّةُ المُذاب اللازمةُ لعمل محلول مشبع عند درجة حرارة معيّنة.
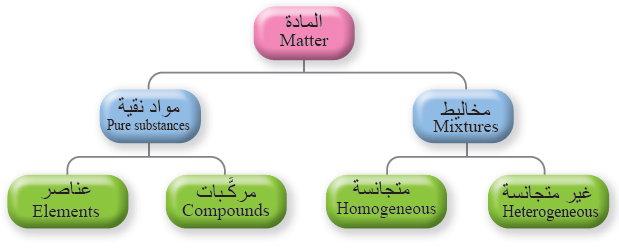
أنواعُ المخاليط Types Of Mixtures
1- المخاليطُ غيرُ المُتَجانِسة Heterogenous Mixtures
تتكون من مادّتين أو أكثرَ منَ الموادّ النقيّة لا تمتزجُ مُكوّناتها امتزاجًا تامًّا؛ إذ تحتفظُ كلٌّ منها بخصائصها الكيميائيّة وتبقى في المخلوط متمايزةً عن غيرها منَ المُكوّنات.
وتقسم إلى:
1- المخلوطُ المُعَلَّق Suspension Mixture لا تمتزج مُكوّناته معَ بعضها بعضًا.
2- المخلوطُ الغَرَوِيّ Colliod Mixture يتكوّنُ من جُسيمات تنتشرُ خلالَ مادّة أُخرى تسمّى وسطَ الانتشار.
2- المخاليطُ المُتَجانِسة ( :Homogeneous Mixture ( Solution
تتكون من مادّتين أو أكثرَ لا يحدثُ بينهما تفاعلٌ كيميائيّ، ويسمى المخلوط المتجانس محلول Solution ، وتنتشرُ جُسيماتُ المُذاب على نحوٍ منتظم ومتماثل في جميع أنحاء المُذيب لذلك يكون المحلولُ مُتَجانِسًا في التركيب والخواصّ.
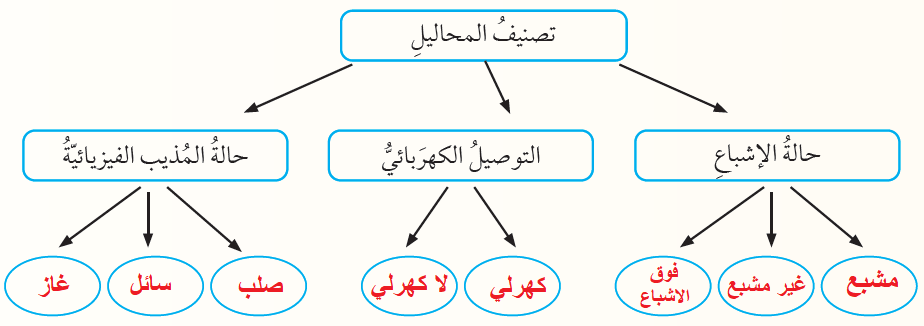
تصنيف المحاليل السائلة:
1- صلب في سائل.
2- سائل في سائل.
3- غاز في سائل.
قانون هنري Henrys Law : ينصُّ على أنّ «ذائبيّةَ الغاز في سائل ما تتناسبُ طرديًّا معَ الضغط المؤثِّرِ في سطح السائل عند ثبات درجة الحرارة »